

发布时间:2023-12-06
面肌痉挛的主要特征表现为由面神经所支配的肌肉发生越来越严重的、不自主的、不规律、持续或非持续的抽搐[6]。面肌痉挛症状中最典型的是单侧的。疾病开始的时候,大多数病人面肌痉挛首先发生在眼轮匝肌。逐步扩展到该侧脸的其他区域。在一些严重的病人中,甚至颈阔肌也受到影响(figure 1)。在大多数病例中,睡觉时也会伴随相应的症状[6]。我们有五个病人抱怨说能听到敲击的声音,这可以用镫骨肌的收缩来解释。
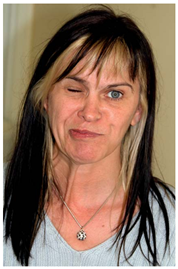
Figure 1明显右侧面肌痉挛的患者,颈阔肌的牵连清晰可见
面肌痉挛的病人主要忍受社交方面带来的心理压力。更严重的是,严重的眼轮匝肌痉挛可能损伤两侧视力,进而对阅读和开车造成影响[7]。在心理压力大和说话的情况下这些症状还会加重。很多病人都是由早期的脸部神经麻痹经过几年的时间逐步发展成面肌痉挛。与其他运动障碍相比,面肌痉挛患者并没有比普通人群更多的精神病理学反常表现(如焦虑症)[8]。
面肌痉挛诊断方面的障碍在于与颅颈区其他运动障碍性疾病所区分。主要的诊断鉴别为:
[*] 眼睑痉挛(Blepharospasm)
[*] 嘴及下颔肌张力异常症(Oromandibular dystonia)
[*] 面神经抽搐(Facial nerve tic)
[*] 咀嚼肌痉挛(Hemimasticatory spasm)
[*] 局灶性癫痫发作(Focal seizures)
[*] 协同性自动运动(Synkinesias after facial nerve paralysis)[6]
与面肌痉挛完全单侧的症状相比,眼睑痉挛表现为双侧、无意识、多数情况下同步发作、眼睑的对称收缩;嘴及下颔肌张力异常症表现为无意识的、重复性、持续性肌肉收缩,主要影响脸部的下部、嘴、上颌骨和下颌骨、舌头及咽;面神经抽搐表现为复杂的、协调的、多病灶运动模式,在左脸和右脸间来回转换;与面肌痉挛相比,抽搐的典型特征是能被抑制[6]。简单的局灶性癫痫发作(Simple focal seizures)在影响到面神经的情况下很容易与面肌痉挛相混淆。协同性自动运动是面神经麻痹后导致由面神经所支配的一些肌肉收缩。它只发生在随意性运动的情况下。
面肌痉挛的诊断最终需要专业医生来判定。
病因学和病原生理学
面肌痉挛的根本原因主要是因为一个扩张的或变形的血管压迫到出脑干区(REZ)的面神经[9]。病理解剖上称为出脑干区,具有以下几个特征:神经纤维仅由蛛网膜包裹,而不包含神经外膜。此外,无结缔组织隔膜穿过各个神经束。该区域同时也是中枢神经(胶质细胞)和外周神经(许旺细胞)间的过渡带[10]。所有这些特征均导致神经纤维越来越高的易损性和对刺激(如压迫)的敏感性。
由面神经压迫所导致的面肌痉挛的发病机理有几种理论来解释。“神经末梢”假设理论认为,神经元间接触异常和刺激异常发生于出脑干区。神经元间接触脉冲的传导以相邻神经纤维病理性的脉冲传导为特征[10-12]。异常的神经传导是受压迫区域的神经传导的自发的发展。而“中枢派”则认为这是脑干的面部运动核过度兴奋[10,11]。对于患者发病年龄较大的解释是“在整个生命过程中,神经纤维逐步扩张和伸长可能会影响小脑桥脑角中的血管。患者还有一个独特的共同点就是患有高血压。随着时间的流逝,最终导致血管和神经接触,从而引发压迫。据推测,压迫反过来导致局灶性脱髓鞘,从而导致上述的电生理过程。
此外,还有一些极其罕见的因素引发面肌痉挛,包括所有类型的小脑桥脑角的占位损伤(如神经鞘瘤、脑膜瘤、蛛网膜囊肿)[4,6]。脑干的病变也会导致相应的症状。这包括神经胶质瘤、脱髓鞘神经系统疾病(如多发性硬化、脑干梗死)。据报道这些症状可由面神经的损伤导致的贝尔氏麻痹症(Bell’s palsy)所触发[4]。
在我们临床中的110例患者中,我们清楚地发现出脑干区的压迫是面肌痉挛的主要病因,只有两例病人例外。
诊断性评价
临床特征对于面肌痉挛的诊断至关重要。能帮助诊断的其他方法包括肌电图(EMG)[13]和核磁共振成像(MRI)。核磁共振成像(MRI)还是一个很有用的工具,它可以排除小脑桥脑角中的病理性改变,如肿瘤和脑干损伤。高分辨率T2-序列(注:一种核磁共振技术的术语,是一种成像序列)对显示可能的血管压迫非常有效,如轴面剥离稳态构成干扰(CISS)序列,这样就可以看到脑脊液、神经、和血管的高分辨率的视野(figure 2)。
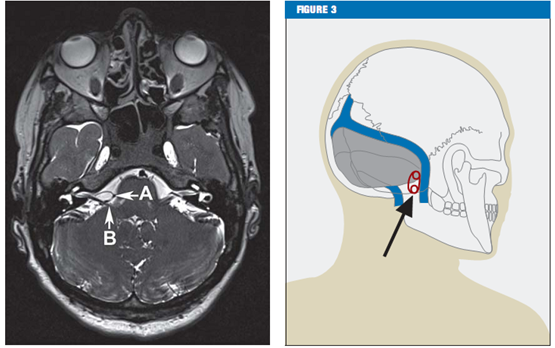
Figure 2 CISS序列的轴面显示脑干部位后下小脑动脉(箭头A)压迫面部神经(箭头B)
Figure 3图形显示乙状窦后入路开颅位置
在大多数病例中,小脑右下动脉(inferior posterior cerebellar artery,PICA)或小脑前下动脉(inferior anterior cerebellar artery ,AICA)是压迫的主因。很少有椎动脉或这些动脉共同引发的压迫。在很罕见的病例中,也有静脉引发压迫的报道。
药物治疗
治疗面肌痉挛的药物有卡巴咪嗪、氯硝安定、巴氯芬,以及具有同样效果的抗惊厥药,如加巴喷丁[6]。据报道,药物治疗成功率较低,使用不广泛,效果不可持续。基于这些原因,药物治疗在大多数研究中[6,14]被认为是不满意的,或者仅用于患者症状轻微的病例中。有报道称,部分患者伴随有严重的副作用(如疲劳、精疲力竭)且效果差。
肉毒毒素
肉毒毒素是一种神经毒素,它能通过不可逆的阻塞突触前神经末梢的类胆碱的信号通路,从而导致肌肉麻痹[15]。自从20世纪80年代早期,肉毒毒素始用于局部注射治疗面肌痉挛。从那时起,肉毒毒素注射疗法成为面肌痉挛的标准对症疗法。据报道该疗法具有显著的减缓病人的症状,有效率85%-95%[6,16,17]。一般副作用有短暂的面神经麻痹(23%)、复视(17%)、上睑下垂(15%)、恶心、过敏反应[6,14,16]。对肉毒毒素的抗体较少发现。
该疗法最大的缺点是有效性有限、每3-4个月需重复注射[6,14,17]。这种疗法只能改善症状。另外,据报道患者在持续注射肉毒毒素几年之后疗效明显降低。
总的来说,肉毒毒素注射法是一种微创的、对面肌痉挛有显著作用且副作用较小,甚至可在门诊进行。
对于某些类型的病人,局部肉毒毒素注射疗法是唯一有效的治疗手段。这种疗法适用于某些不适合手术治疗的患者。例如,患者对麻醉剂高度敏感,或这些患者的面肌痉挛不是由血管压迫引起的。
微血管减压术
面神经的微血管减压术是治愈面肌痉挛的唯一治疗选择。手术旨在去除出脑干区(REZ)血管对神经的压迫。血管对神经造成压迫是主要病因。手术需全身麻醉。为了观察手术过程中耳蜗的和面部的神经的改变,需要在手术进行过程中对面神经的肌电图(EMG)和听觉诱发电位(auditory evoked potentials)进行监测。使用乙状窦后入路开颅术(retrosigmoidal craniotomy)(figure 3)暴露小脑桥脑角。在随后的手术过程中,尤其注意检查出脑干区的面神经(figure 5),该面神经发源于脑干。内窥镜检查法对于确定血管压迫位置很有效(figure 4,6)。因此,在我们医院把内窥镜检查法作为指导程序。
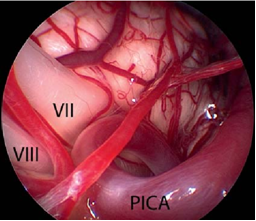
Figure 4内窥镜图像(使用30°内窥镜拍摄)显示了出脑干区的蜗神经和面神经的临近部位,它们被小脑后下动脉(PICA)环所压迫(与figure 2是同一患者)
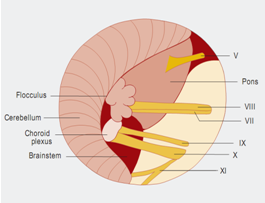
Figure 5小脑桥脑角区解剖示意图:Ⅴ=三叉神经;Ⅷ=蜗神经;Ⅶ=面神经;Ⅸ=舌咽神经;Ⅹ=迷走神经;Ⅺ=脊附属神经。
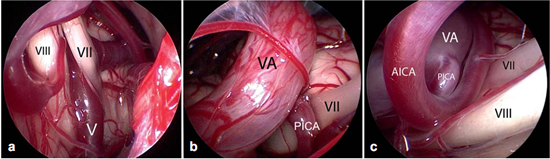
Figure 6不同类型的血管压迫。Ⅶ=面神经;Ⅷ=蜗神经
a:由靠近脑干的静脉(Ⅴ)所造成的压迫;
b:椎动脉(VA)和小脑右下动脉(PICA)共同压迫;
c:椎动脉(VA)、下移的小脑右下动脉(PICA)和小脑前下动脉(AICA)共同压迫。
临床上通过在血管和脑干间的位置放置一个聚四氟乙烯海绵达到去压迫的目的(figure 7)。在一些复杂案例中(例如患者的血管直径过大或者血管硬化),则需要使用聚四氟乙烯吊索把产生压迫的血管缝合到硬脑膜上,这样才能够完全去除压迫。
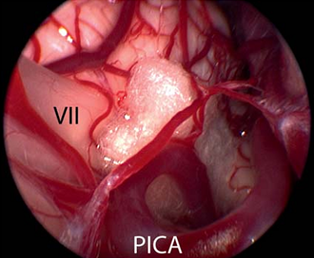
Figure 7纤维手术将面神经和血管分离后,在面神经和血管间置入聚四氟乙烯海绵体,达到永久性防止血管压迫。(Ⅶ=面神经;小脑右下动脉(PICA))
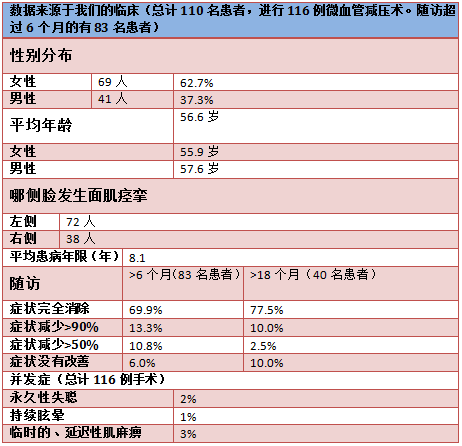
文献报道微血管减压术术后第一年的平均成功率为80%-88%[14,18,19]。这与我们的临床试验结果相符(table)。随访结果显示,6个月的手术成功率(手术成功指肌痉挛减少90%以上)为83%,18个月为87%。在症状改善有限或根本无效的病人中,手术不成功的主要原因是独特的解剖结构,如大直径静脉、动脉位于面神经和前庭蜗神经之间、极细长和在狭小的髓周空间里膨胀的椎动脉[14,18,19]。
和其他任何外科手术一样,微血管减压术也存在一定的手术风险。主要风险是短暂的或永久性的听力损伤,甚至造成单侧失聪。据报道,在一些规模较大的临床研究中风险为1.5%-8%[14,18-21]。永久性的面神经麻痹的风险为0.7%-0.9%[9,22]。延迟的面神经麻痹更普遍(病例数的3%-8%)。术后面神经的起初功能完整。但是,在平均12天之后,手术一侧的面神经可能会突发急性的高水平的麻痹。与之相关的一个可能的原因是带状疱疹的激活。然而,到目前为止,面神经的延迟麻痹的病原学还未确定[22]。几乎所有患者都会随着时间症状逐渐消失。微血管减压术围手术期危及生命的风险(如占位出血、小脑或脑干梗塞)小于1%。我们在临床上还未遇到这样的病例。总之,我们可以认为该方法成功率高,风险水平是可接受的。事实上,患者因该手术疗法得以长期免除疾病的痛楚。
TABLE
结论
局部肉毒毒素注射是一种可接受的、低风险的面肌痉挛治疗方法。尤其是对于一些有很高的麻醉风险、温和的面肌痉挛、不接受手术的患者,该法是最佳选择。
关键信息:
Ø 面肌痉挛是一种由面神经影响的肌肉的运动障碍。导致面部肌肉不自主的持续或非持续的收缩,这主要发生在单侧脸。
Ø 大多数病例的病因为一个畸变的或扩张的血管压迫了出脑干区的面神经。
Ø 临床特征引领了面肌痉挛的诊断。选择治疗方案的难点在于和其他面部运动障碍性疾病的区别。使用CISS程序的核磁共振成像对于诊断血管压迫和其他颅内病因是有显著效果的。
Ø 最重要的症状疗法是局部肉毒毒素注射。超过85%的受试病人的症状得到显著改善。此疗法的缺点是每隔几个月就需要重复注射。
Ø 微血管减压术是唯一的、永久性的有效率为85%的方法。
然而,要想长期免除病痛, 唯一能实现的治疗手段只有微血管减压手术,这是一个相对低风险高成功率的治疗方法。选择手术治疗应该向那些确定为面肌痉挛的所有的病人告知,有明确的临床症状,因为这种治疗代表的是唯一针对病因治疗方式。尤其是在年轻病人,作者建议早期手术。因为,在我们所见到的那些未经手术的患者(长期注射肉毒杆菌的患者)结果都是很差的,往往这时面部神经已经发生了结构性破坏,这是在我们在手术时常常亲眼所见的。
参考文献:
1. Auger RG, Whisnant JP: Hemifacial spasm in Rochester and Olmsted County, Minnesota, 1960 to 1984. Arch Neurol 1990; 47: 1233–4.
2. Nilsen B, Le KD, Dietrichs E: Prevalence of hemifacial spasm in Oslo, Norway. Neurology 2004; 63: 1532–3.
3. Tan EK, Chan LL: Young onset hemifacial spasm. ActaNeurolScand 2006; 114: 59–62.
4. Yaltho TC, Jankovic J: The many faces of hemifacial spasm: differential diagnosis of unilateral facial spasms. MovDisord 2011; 26: 1582–92. doi: 10.1002/mds.23692.
5. Felício AC, Godeiro-Junior Cde O, Borges V, Silva SM, Ferraz HB: Bilateral hemifacial spasm: a series of 10 patients with literature review. Parkinsonism RelatDisord 2008; 14: 154–6.
6. Wang A, Jankovic J: Hemifacial spasm: clinical findings and treatment. Muscle Nerve 1998; 21: 1740–7. 7. Wilkins RH: Hemifacial spasm: a review. SurgNeurol 1991; 36: 251–77.
8. Scheidt CE, Schuller B, Rayki O, Kommerell G, Deuschl G: Relative absence of psychopathology in benign essential blepharospasm and hemifacial spasm. Neurology 1996; 47: 43–5.
9. Girard N, Poncet M, Caces F, Tallon Y, Chays A, Martin-Bouyer P, Magnan J, Raybaud C: Three-dimensional MRI of hemifacial spasm with surgical correlation. Neuroradiology 1997; 39: 46–51.
10. Nielsen VK: Electrophysiology of the facial nerve in hemifacial spasm: ectopic/ephaptic excitation. Muscle Nerve 1985; 8: 545–55.
11. Møller AR: Vascular compression of cranial nerves: II: pathophysiology. Neurol Res 1999; 21: 439–43.
12. Møller AR, Jannetta PJ: On the origin of synkinesis in hemifacial spasm: results of intracranial recordings. J Neurosurg 1984; 61: 569–76.
13. Wilkins RH: Hemifacial spasm: a review. SurgNeurol 1991; 36: 251–77.
14. Barker FG 2nd, Jannetta PJ, Bissonette DJ, Shields PT, Larkins MV, Jho HD: Microvascular decompression for hemifacial spasm. J Neurosurg 1995; 82: 201–10.
15. Jitpimolmard S, Tiamkao S, Laopaiboon M: Long term results of botulinum toxin type A (Dysport) in the treatment of hemifacial spasm: a report of 175 cases. J NeurolNeurosurg Psychiatry 1998; 64: 751–7.
16. Yoshimura DM, Aminoff MJ, Tami TA, Scott AB: Treatment of hemifacial spasm with botulinum toxin. Muscle Nerve 1992; 15: 1045–9.
17. Simpson DM, Blitzer A, Brashear A, et al.: Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Assessment: Botulinum neurotoxin for the treatment of movement disorders (an evidence-based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2008; 70: 1699–706. 18. Yuan Y, Wang Y, Zhang SX, Zhang L, Li R, Guo J: Microvascular decompression in patients with hemifacial spasm: report of 1200 cases. Chin Med J (Engl) 2005; 118: 833–6.
19. Dannenbaum M, Lega BC, Suki D, Harper RL, Yoshor D: Microvascular decompression for hemifacial spasm: long-term results from 114operations performed without neurophysiological monitoring. J Neurosurg 2008; 109: 410–5.
20. Jo KW, Kim JW, Kong DS, Hong SH, Park K: The patterns and risk factors of hearing loss following microvascular decompression for hemifacial spasm. ActaNeurochir (Wien) 2011; 153: 1023–30.Epub 2011 Jan 15.
21. Samii M, Günther T, Iaconetta G, Muehling M, Vorkapic P, Samii A: Microvascular decompression to treat hemifacial spasm: long-term results for a consecutive series of 143 patients. Neurosurgery 2002; 50: 712–8; discussion 718–9. 22. Lovely TJ, Getch CC, Jannetta PJ: Delayed facial weakness after microvascular decompression of cranial nerve VII. SurgNeurol 1998; 50: 449–52.