

发布时间:2023-12-06
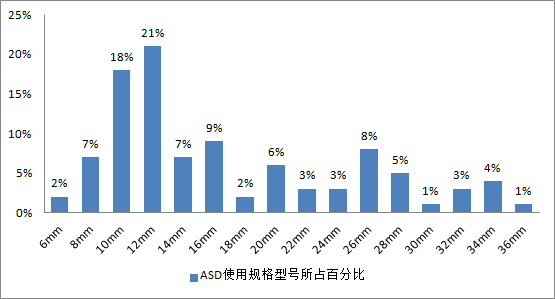
全组连续生产并实现植入患者体内的100枚佰仁封堵器,总计用于100位患者,最早手术日期为2007年6月13日,最晚手术时间是2011年5月25日,累加总随访为386病人-年,算数平均随访时间约为3.86年/例(386/100);随访到每位入组患者,没有失访。其中男性患者40例,女性患者60例,最小年龄为2岁,最大年龄为80岁,年龄算数平均为20.216岁。在所实施的房间隔损介入封堵器术中,随访植入规格型号各占比例如下图:
3、结果
在植入100枚封堵器的100位患者中, 4年患者实际生存率为100% (100/100)。本组随访过程中,全部患者没出现死亡、二次手术、心律失常、传导阻滞、心动过速、感染及封堵器移位脱落、栓塞等症状的病例。在历年例行产品质量体系检查或产品质量突击稽查等诸多检查中,房缺封堵器产品一直是本企业零问题产品。随访患者中,没有发生不良事件及投诉举报。
4、讨论
房间隔缺损是常见的先天性心脏病之一。近年来,随着心脏超声检查及心导管技术的进步和封堵器材料的改善,经导管介入治疗房间隔缺损已逐渐取代传统的开胸修补手术,成为具有适应证患者的首选治疗方式。通过封堵治疗房缺已经是一种成熟 的治疗方法。与外科手术相比,经导管封堵治疗创伤小、不留明显手术疤痕,并发症少、治疗时间短、不需输血,具有独特的优势;随着国产封堵器的临床广泛应用大大降低了治疗费用,为广大医患所接受。
通过本次随访统计分析,随访过程中全部患者均无并发症。比较使用进口封堵器与使用佰仁封堵器患者的各方面情况,我们可以看到两种封堵器在适用范围、易操作性、手术成功率及并发症发生率等方面无差异;表明佰仁封堵器与进口封堵器在临床应用上没有明显不同。但使用佰仁封堵器可以大大降低患者的治疗费用,有利于封堵治疗的开展,可以使更多房缺患者接受封堵治疗,不会因费用问题得不到治疗。本公司生产的ASD封堵治疗的临床效果明显,安全性较好,适合在临床广泛使用。我们认为佰仁封堵器具有安全、有效、价格效益比高的优点,符合安全、有效、经济的治疗策略。
目前应用广泛的先天性心脏病封堵器的材料主要为镍钛合金。镍离子析出对先心病封堵器长期植入人体影响的分析如下:
镍钛合金具有质轻、强度较高、耐疲劳、耐腐蚀和高回弹性等优点, 是一种具有发展潜力的金属生物材料。其应用范围逐渐涉及航空、能源、建筑、民用和医学等多个领域。该封堵器由超弹性镍钛合金丝编织而成, 外形呈圆盘形, 两个圆盘中间部分为圆柱形, 封堵器两端受力牵拉时呈线条状, 放松后可自行恢复原状。因其操作简单, 可通过较小的鞘管、可堵闭较大的缺损且残余分流量小而在临床使用中得到肯定[ 1]。然而封堵器是由镍钛合金材料制成,镍为具有潜在毒性的金属。
镍的毒性作用有可靠证据表明, 镍是人体必需元素, 正常人的血清镍浓度 < 2 ng/m l。动物研究表明, 镍可能与生物素、叶酸和维生素 B12代谢有密切关系。但在对人体有潜在毒性的金属中, 镍仅次于银。如果将镍材单独植于生物体内, 溶出的镍元素将产生很大细胞毒性 [ 2]。镍进入机体后, 主要沉积在皮肤、中枢神经系统、肾脏及肝脏中。镍能够结合到核糖核酸 ( RNA)和蛋白质上, 使 RNA 和蛋白质解聚。镍还妨碍肌肉收缩, 破坏酶的作用。低浓度的镍 ( 15 Lg /m l~ 30 Lg/m l)可抑制体外培养的成纤维细胞生长。当镍被吸收到血液中, 可与A巨球蛋白复合成镍纤维蛋白溶酶。纯镍元素及镍盐已被证实有致癌作用, 亚硫化镍、硫化镍都具有致癌作用 [ 3]。有证据表明, 电解车间工人接触可溶解性镍盐 ( 0. 5~ 2. 0 mg/m3) , 或较不溶解镍化合物 ( 0. 1~ 0. 5mg/m3), 可使发生肺癌和鼻癌的危险性增加 [ 4]。一般认为, 肺癌和鼻癌的危险增加与接触大于 1. 0mg/m3镍的可溶性镍浓度和超过 1. 0mg /m3镍的较不易溶解镍物质 (氧化物、次硫化物 )相关联。另外, 镍是最常见的金属致敏原之一 [ 5]。长期吸入、接触镍的直接影响包括哮喘、慢性肥大性鼻炎和鼻窦炎、鼻息肉及鼻中隔穿孔。并常可发生过敏性皮炎。阮建明等 [ 6]采用体外细胞培养模式, 通过测定细胞碱性磷酸酶 ( ALP)活性及细胞四甲基偶氮砜 (MTT) 还原能力, 对镍毒性进行了定量评估。当溶液离子度高于 100Lmol/ L时, 镍表现强烈毒性。
现在多数学者认为, 镍钛合金是一种安全的体内植入材料 [ 7-10], 归纳原因如下: 镍钛合金表面的钝化膜主要由氧化钛构成, 只含有极微量的镍,这是其组织反应良好的根本原因; 镍钛合金中的镍以化合态存在, 即使在人体有解离, 也是极微量的; 在体外实验中观察到的细胞毒性反应是由于镍逐渐浓集所致, 并不会发生在正常使用的体内环境中。由于钛元素与氧的结合力比镍元素强,故合金表面覆盖的氧化物薄膜层中主要是 TiO2,而只有少量原子态的镍 (原子含量约为 0~ 2% )。对于先心病封堵器的生物相容性, 国内外有学者也做了相关研究。Sigler等 [ 11] 证实了先心病封堵器具有良好的生物相容性和安全性。
总之,由于该封堵器具有设计合理、操作简单、安全性高、封堵效果好等特点,以镍钛合金为材料的先心病封堵器植入人体后, 虽然其具有良好的生物相容性及安全性,镍离子析出对长期植入人体的机体影响仍然未有定论, 需进一步的观察研究。
5、问题、改进和建议
本次随访存在的主要问题是病例的入组及经销商的管理。由于产品出厂面对上百家用户和多家经销商,他们主要根据患者需要订货、发货,即便是连续生产的产品,并非能得到连续应用,即可能先出厂的产品在很久以后才用,甚至到过期未用。本组100枚封堵器被用于7家医院,仅用15枚及以下的医院就有5家,由于早期缺乏经验,每家经销商,每位销售代表没有强制约定分销记录,部分销售代表缺乏规范要求,造成部分产品追溯困难,加上早期销售代表销售薄弱。对此,公司在所有经销合同中,增列专门条款,如不能按月提供分销记录或不能回收患者随访卡,将被取消所有优惠要求,并作为是否年度续签合同的否决性条款,以保证随访信息的适时性和完整性。
鉴于临床使用是我们征集产品质量信息第一来源,公司在例会上决定加大对术后随访工作,重视术后信息收集、整理、反馈及服务水平,进一步加强对销售人员的培训,制定切实可行的销售政策。本组连续生产并实现植入患者体内的100枚封堵器,如果没有医生和医院的支持,随访将很难完成!这也本次随访难度较大、耗时较多的。建议能从卫生局-医院系统建立法规,把积极配合随访,作为医院管理与考核的内容,以确保公司产品长期随访的获得必要支持。
6、综述
近几年来,公司该产品无不良事件及投诉举报发生。我公司自取证生产至今,始终坚持“以仁为本,聚识谋进,精益求新,独创精品,再塑高品质人生。”的质量方针,以救治数百万患先心病同胞为己任,要求每位员工都以“视为已用”的心态去完成每一件产品。产品质量一直保持稳定并在不断进步,产品出厂检验,周期检验,送检报告结果均符合标准要求,用户反馈信息良好,无重大产品质量投诉。产品使用性能均符合并满足顾客要求,产品适用性强,具有广泛的市场前景,今后我们将继续不断努力,不断进取,遵循有关法规要求严格执行有关制度并广泛征询使用单位意见,收集产品质量信息,为不断改进公司产品质量,为发展和开拓我国的医疗事业而不懈努力。
参考文献:
1.秦永文, 丁仲如. 先天性心脏病的介入治疗现状与进展 [ J].中国心血管病研究杂志, 2005, 3( 8): 563-566.
2.张鹏, 苏佳灿, 许硕贵. 镍钛形状记忆合金的表面改性对其生物相容性的影响 [ J]. 国际生物医学工程杂志, 2006, 29 ( 1): 39-41.
3.W agner JR, SorgentiniDA, AnonMC. Relation between solubi-lity and surface hydrophobicity as an indicator of modificationsduring preparation processes of commercial and laboratory-pre-pared soy protein isolates[ J]. JAgric Food Chem, 2000, 48( 8): 3159-3165.
4.胡勇强, 李明. 镍毒性的临床反应 [ J] . 国外医学-医学地理分册, 2000, 21( 3): 121-130.
5.Rahilly G, Prrice N. N ickel allergy and orthodontics[ J]. Orthod, 2003, 30( 2): 171-174.
6.阮建明, G rantMH, 黄伯云. 金属毒性研究 [ J]. 中国有色金属学报, 2001, 11( 6): 960-966.
7.Ryhanen J, Kallioinen M , Tuukkanen J, et al. In vivo bio-compatibility eva luation of nickel titanium shape memory metalalloy: muscle and perineural tissue responses and cap-sule membrance thickness [ J]. J BiomedM aterRes, 1998, 41 ( 3): 481-488.
8.Bogdanski D, K ollerM, M ullerD, et al. Easy assessment of the biocompatibility of N -i T i alloys by in vitro cell culture exper-iments on a functionally gradedN -iN iT -iT imaterial[ J]. Biomate-rials, 2002, 23( 23): 4549-4555.
9.A rmitageDA , ParkerTL, G rant DM, et a.l Biocompatibility and hemocompatibility of surface-modified N iT i alloys[ J]. B iomed M aterResA, 2003, 66( 1): 129-137.
10.P rymak O, BogdanskiD, Ko llerM, et a.l M orphological charac-terization and in vitro biocompatibility of a porous nicke-l titanium alloy[ J]. Biomaterials, 2005, 26( 29): 5801-5807.
11.SiglerM, Handt S, SeghayeMC, et a.l Evaluation of in vivo bio-compatibility of different dev ices for interventional closure of the patent ductus arteriosus in an animalmodel[ J]. H eart, 2000, 83 ( 5): 570-573.